Rheumatologische Labor-Basisdiagnostik
Bei der Diagnostik rheumatischer Syndrome kommt der Differenzierung zwischen entzündlichen und nicht entzündlichen Ursachen der Beschwerden grundsätzliche Bedeutung zu. Als erste Stufe einer rationellen rheumatologischen Basisdiagnostik sollten daher – ergänzend zur klinischen Befunderhebung – die folgenden Laborparameter untersucht werden [9, 10]
| Abkürzung | Analyt | diagnostische Relevanz |
|---|---|---|
| BSG/ESR | Blutkörperchen-Senkungsgeschwindigkeit, Erythrozytensedimentationsrate | Entzündungsaktivität |
| CRP | C-reaktives Protein | Entzündungsaktivität |
| BB und Diff-BB | Blutbild und Differentialblutbild | Entzündungsaktivität, Anämie, Leukopenie, Eosinophilie, Thrombozytose, Thrombopenie |
| ELPHO | Serumelektrophorese, ggf. Immunfixationselektrophorese | akute/chronische Entzündung, monoklonale Gammopathie |
| Ferritin | Ferritin | Hämochromatose, chronische Entzündung, Eisenmangelanämie |
| HS | Harnsäure | Gicht |
| Urinstatus | Urinstatus (Stix und Sediment) | z. B. Proteinurie, Nephritis, Harnwegsinfekt, Gicht |
| GOT, GPT | Transaminasen | Leberbeteiligung |
| AP, γ-GT | Alkalische Phosphatase, Gamma-Glutamyl-Transferase | Leber-, Knochenbeteiligung |
| Ca, PO4 | Calcium, Phosphat anorganisch | Knochenbeteiligung |
| CREA | Creatinin | Nierenbeteiligung |
| CK, LDH | Creatinkinase, Lactatdehydrogenase | Muskelbeteiligung, Polymyositis |
| RF, CCP-Ak | Rheumafaktor, cyklische citrullinierte Peptide-Antikörper | Rheumatoide Arthritis |
| ANA | Antinukleäre Antikörper | Kollagenosen |
Bei entzündlichem Rückenschmerz sollte zusätzlich die immungenetische Untersuchung auf HLA B 27 (Sakroiliitis, Spondarthritis) erfolgen[9]. Bei Fieber, Nachtschweiß, Gewichtsverlust und Arthralgien und gleichzeitigen vaskulitischen Leitsymptomen (z. B. Episkleritis, Hörsturz, Purpura, Ulcerationen, Livedo reticularis, Mono-/Polyneuritis, Hämaturie) sollten zur Abklärung einer ANCA-assoziierten Immunvaskulitis Proteinase 3- und Myeoloperoxidase-Antikörper (PR3-ANCA, MPO-ANCA, Immunvaskulitis) mitbestimmt werden.
C-reaktives Protein (CRP) [10, 11]
In Ergänzung des klinischen Befundes dienen als wichtigste Analyte zur Differenzierung zwischen entzündlicher und nichtentzündlicher Erkrankung das C-reaktive Protein (CRP) und die Blutsenkungsgeschwindigkeit (s. u.). CRP besitzt eine wichtige Funktion bei der Abwehr bakterieller Pathogene und der Abräumung apoptotischer und nekrotischer Zellen. Bei Akute-Phase-Reaktionen wird die Transskription des CRP-Gens hauptsächlich durch Interleukin 6 hochreguliert. CRP reagiert schneller als die Blutsenkungsgeschwindigkeit (Anstieg 6 h nach einem akuten Ereignis, Maximalwert nach 48 h, Halbwertszeit 48 h).
Die CRP-Konzentration im Serum korreliert mit der Entzündungsaktivität. Bei der Rheumatoiden Arthritis werden bei mehr als 90 % aller Erwachsenen erhöhte CRP-Werte gefunden. Bei klinisch manifester Erkrankung korreliert die CRP-Konzentration mit der Krankheitsaktivität, Werte bis 50 mg/L sprechen für eine geringe, Konzentrationen > 100 mg/L für eine sehr hohe Aktivität. Die CRP-Konzentration korreliert allerdings nicht gut mit klinischen Symptomen der Rheumatoiden Arthritis, der Blutsenkungsgeschwindigkeit und dem Rheumafaktor. Ruhe, Analgetika und nicht-steroidale Antirheumatika beeinflussen die CRP-Konzentration nicht, während Immunsuppressiva (Cortison) zu einem schnellen Rückgang des CRP-Spiegels führen.
Bei andereren Kollagenosen (z. B. SLE, Polymyositis, Sclerodermie) kann die CRP-Konzentration dagegen auch in Schubsituationen im Referenzbereich liegen. Bei CRP-Werten über dem Referenzbereich kommt es zu Überschneidungen mit Konzentrationen, die auch bei Infektionen möglich sind. Werte über 100 mg/L sprechen hierbei in der Regel für eine bakterielle Infektion.
Tabelle 4: Typische CRP-Konzentrationen bei rheumatischen Erkrankungen
| CRP normal | CRP bis 50 mg/L | CRP > 50 mg/L |
|---|---|---|
|
|
|
Blutkörperchen-Senkungsgeschwindigkeit (BSG) [10, 11]
Die BSG wird sowohl durch Akute-Phase-Proteine als auch durch Veränderungen der Immunglobulinkonzentrationen im Plasma sowie durch Immmukomplexe beeinflusst. Bei chronischen rheumatischen Erkrankungen ist die BSG daher ein besserer Indikator des längerfristigen Krankheitsverlaufs als das CRP. Dies gilt vor allem für die Kollagenosen, aber auch für die Polymyalgia rheumatica (PMR). Bei der Arteriitis temporalis ist die starke Beschleunigung der BSG pathognomonisch. Virusinfektionen beeinflussen die BSG weniger als die CRP-Konzentration.
Tabelle 5: Blutsenkungsgeschwindigkeit bei rheumatischen Erkrankungen
| BSG häufig nicht erhöht | BSG mäßig beschleunigt < 50 m/h | BSG erheblich beschleunigt > 50 mm/h |
|---|---|---|
|
|
|
Autoimmunerkrankungen wie rA oder SLE repräsentieren eine häufige und wichtige Gruppe innerhalb der entzündlichen rheumatischen Erkrankungen. Die wichtigsten diagnostischen Screeningtests stellen die Bestimmung des Rheumafaktors (RF), der CCP- sowie der Antinukleären Antikörper (ANA, siehe dort) dar.
Rheumafaktor (RF), Antikörper gegen cyklische citrullinierte Peptide (CCP-Ak)
Der Begriff des Rheumafaktors umschreibt einen Autoantikörper (gewöhnlich vom IgM-Isotyp) gegen die konstante Fc-Region von Immunglobulin G. Die RF-Bestimmung ist die häufigste Autoantikörperanalyse, der RF-Nachweis stellt ein diagnostisches Kriterium der rheumatoiden Arthritis dar. Die RF-Bestimmung weist jedoch bezüglich ihrer diagnostischen Aussagekraft einige erhebliche Nachteile auf [2]:
- in der Frühphase der Erkrankung geringe Sensitivität: in der klinischen Frühphase der rheumatoiden Arthritis sind RF nur bei 40 - 50 %, vor der klinischen Manifestion nur bei etwa 1/3 der Fälle nachweisbar
- geringe Spezifität: RF finden sich häufig auch bei Gesunden (bis zu 30 % ) oder anderen Erkrankungen (SLE bis 35 %, SJS 75 – 95 %, systemische Vaskulitis 5 – 20 %, Sarkoidose 5 – 30 %, chronische Leber-erkrankungen 15 – 70 %, bakterielle und virale Infekte 5 – 65 %, Parasitosen 20 – 90 %)
Die isolierte Bestimmung des Rheumafaktors kann daher nicht mehr empfohlen werden.
Antikörper gegen cyklische citrullinierte Peptide (CCP) reagieren mit unterschiedlichen, im menschlichen Körper vorkommenden citrullinierten Polypeptiden. Wie in zahlreichen Studien bestätigt wurde, weist bei V. a. rheumatoide Arthritis die Bestimmung von anti-CCP gegenüber der RF-Bestimmung folgende Vorteile auf:
- hohe Spezifität (86 bis > 99 %, meist > 95 %)
- hohe Sensitivität (68 bis 91 %), auch in der Frühphase der Erkrankung (bis zu > 80 %)
- CCP-Ak finden sich bei etwa 50 % der RF-negativen rA-Patienten
- CCP-Ak korrelieren mit der Entwicklung destruierender Gelenkveränderungen [12, 13]
Anti-CCP können bis zu 9 Jahre vor der Manifestation klinischer Symptome vorhanden sein. Wird bei unklaren arthritischen Symptomen anti-CCP nachgewiesen, besteht ein sehr hohes Risiko (bis zu 93 %) für die Entwicklung einer rA innerhalb von 3 Jahren. Dieser Umstand ist für den Primärarzt, in dessen Praxis sich die Patienten mit den - häufig uncharakteristischen - Frühsymptomen einer chronischen Polyarthritis vorstellen, von überragender Bedeutung. Die kombinierte Untersuchung von CCP-Ak und RF besitzt für die Diagnose einer rA einen positiven prädiktiven Wert von 91 % [12]. Als Konsequenz sollten CCP-Ak und Rheumafaktor zur frühzeitigen Diagnosefindung immer zusammen bestimmt werden. Dieses Vorgehen vermeidet Fehldiagnosen und ermöglicht eine frühzeitige Therapie einer rA, möglicherweise, bevor irreversiblen Gelenkszerstörungen auftreten.
Antinukleäre Antikörper (ANA), ANA-Subspezifitäten
Der Begriff "Antinukleäre Antikörper" (ANA) bezeichnet Autoantikörper, die mit nicht gewebespezifischen Antigenen von Zellkernen, z. B. DNA, Histon- und Non-Histonproteinen oder nukleären Ribonukleoproteinen, reagieren. ANA kommen nicht nur bei systemischen Autoimmunerkrankungen, z. B. Kollagenosen wie SLE oder rA, vor, sondern auch bei organspezifischen Autoimmunerkrankungen wie der autoimmunen Hepatitis, bei vielen Infektionserkrankungen sowie bei gesunden Personen vor.
Die Symptome von Kollagenosen sind äußerst vielfältig (z. B. Müdigkeit, Nachtschweiß, "B-Symptomatik", Haarausfall, Arthralgien/Arthritiden, Raynaud-Phänomen, Haut-/Schleimhauterscheinungen usw.), jedoch uncharakteristisch. Die Bestimmung der Zellkern-Antikörper (ANA) hat deshalb einen hohen Stellenwert bei der Diagnostik von Kollagenosen, weil ein negatives Ergebnis im ANA-Screeningtest einige Kollagenosen (Mischkollagenose/SHARP-Syndrom, SLE, medikamenteninduizierter LE) nahezu sicher ausschliesst (hoher negativ prädiktiver Wert). Andererseits stellt ein positives Ergebnis im ANA-Screening zwar einen wichtigen Hinweis auf eine Kollagenose dar, beweist aber weder ihr Vorliegen, noch erlaubt es die Artdiagnose einer ANA-assoziierten Erkrankung [9, 14]. Neben ihrer Bedeutung für die Ausschlussdiagnostik hat die ANA-Analytik daher in erster Linie als Suchtest Bedeutung [15]:
Tabelle 6: Diagnostische Wertigkeit der ANA-Bestimmung
| ANA-Screening zur Diagnosefindung sehr sinnvoll | ANA nachweisbar in % der Fälle |
|---|---|
| Systemischer Lupus erythematodes (SLE) | 95 - 100 |
| Medikamenteninduzierter Lupus erythematodes (DILE) | 100 |
| Mischkollagenose (MCTD) | 100 |
| Sklerodermie (systemische Sklerose, SSc) | 60 - 80 |
| Autoimmunhepatitis (AIH) | 70 - 80 |
| Sjögren-Syndrom (SjS) | 40 - 70 |
| Poymyositis/Dermatositis | 30 - 80 |
| ANA kommen außerdem vor bei | ANA nachweisbar in % der Fälle |
|---|---|
| Rheumatoide Arthrits | 30 - 50 |
| Discoider Lupus | 5 - 25 |
| Immunthyreoiditiden | 30 - 50 |
| Idopathische thrombozytopenische Purpura | 10 - 30 |
| Multiple Sklerose | 25 |
| Infektionskrankheiten | sehr variabel |
| Maligne Tumoren | sehr variabel |
| Patientinnen mit Silikonbrustimplantaten | 15 - 25 |
| Fibromyalgie | 15 - 25 |
| Verwandte von Kollagenosekranken (SLE und Sklerodermie) | 5 - 25 |
| Gesunde | bis zu 30 |
Bei den heute allgemein verbreiteten Methoden zum ANA-Screening (Immunfluoreszenztest auf Hep2-Zellen, einer Larynx-Karzinom-Zelllinie) gilt als Entscheidungsgrenze für ein positives Resultat ein Titer von 1 : 80 [17] . Unter Gesunden prädisponieren vor allem höheres Lebensalter und weibliches Geschlecht für ein positives Ergebnis im ANA-Screeningtest. Da einerseits auch bei Gesunden mäßige bis mittlere ANA-Titer auftreten können (1 : 320: 3 %, gelegentlich auch höher), andererseits bei Kollagenosekranken im individuellen Verlauf durchaus nur niedrige ANA-Titer (z. B. 1 : 160) nachweisbar sein können, können die Ergebnisse von Kranken und Gesunden überlappen. Da außerdem der ANA-Titer häufig nicht mit der Aktivität einer zugrundeliegenden Kollagenose korreliert und ein positives Ergebnis bei klinisch Gesunden durchaus prädiktive Bedeutung hinsichtlich der künftigen Entwicklung einer Autoimmunerkrankung besitzen kann, müssen positive Ergebnisse im ANA-Screening immer im klinischen Kontext betrachtet werden.
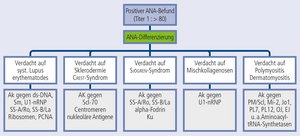
Eine sinnvolle Differenzierung der ANA sollte klinische Fragestellungen und das vorliegende Fluoreszenzmuster berücksichtigen. ANA treten in zahlreichen typischen, z. T. überlappenden Mustern auf, die gewisse Rückschlüsse zur zugrundeliegenden (Sub-)Spezifität zulassen. Da positive Ergebnisse bei der Untersuchung auf ANA-Subspezifitäten die Wahrscheinlichkeit einer Kollagenose erhöhen, sollte bei ANA-Titern ab 1 : 160 eine Differenzierung der ANA erfolgen. Bei negativem ANA-Screening ist dagegen die Untersuchung auf ANA-Subspezifitäten ("ENA") nicht sinnvoll.
Abb. 3 Differenzierung positiver ANA-Befunde aufgrund klinischer Kriterien
| CREST | Akronym, gelegentlich inkomplettes Syndrom des Formenkreises Sklerodermie (Calcinosis cutis, RAYNAUD-Phänomen, Osophagusdysfunktion (engl. esophagus), Sklerodaktylie, Teleangiektasen) |
|---|---|
| Sm | Abkürzung von Smith (Patientenname) B'B, D-Proteine der U-nRNP |
| SS-A/Ro, SS-B/La | SJÖGREN-Syndrom Antigen A und B |
| Ro, La | Abkürzungen von Patientennamen |
| PCNA | proliferating cell nuclear antigen |
| Scl-70 | Sklerodermie-Antigen 70 kD (MG: ca. 90 kD!) |
| Ku | Abkürzung von Patientennamen, 70/80 kD-Herodimer, Bestandteil von nucl. Factor IV |
| PM/Scl | Polymositis/Sklerodermie(-Überlappungssyndrom) |
| Mi-2 | Patientenname, 218 kD-Helicase |
| Jo 1 | Patientenname, Histidyl-t-RNA-Synthetase |
| PL7 | precipitin line 7, Threonyl-tRNA-Synthetase |
| PL12 | precipitin line 12, Alanyl-tRNA-Synthetase |
| OJ | Patientenname, Isoleuycyl-tRNA-Synthetase |
| EJ | Patientenname, Glycyl-tRNA-Synthetase |
Anlass zur ANA-Bestimmung sollte eine adäquate Klinik sein [31]. Bei Polymyositis und Dermatomyositis las-sen sich spezifische Autoantikörper seltener nachweisen. Jo-1-(Histidyl-tRNA-Syntethase)-Antikörper als häufigster dieser Antikörper wurde in nur 18 % aller beobachteten Fälle nachgewiesen [35]. Die Bedeutung einzelner Autoantikörper für den systemischen Lupus erythematodes zeigt die folgende Tabelle.
Tabelle 7: Diagnostische Bedeutung von Antikörpern beim syst. Lupus erythematodes [31, 33, 37, 38]
| Autoantikörper gegen | Häufigkeit in % ca. | Spezifität | klinische Assoziation |
|---|---|---|---|
| Zellkerne (ANA) | > 96 | niedrig | |
| dsDNA | 40 - 90 | hoch | Nephritis, ZNS-Beteiligung, Fieber, hämolytische Anämie |
| Histone | 30 - 90 | niedrig | Medikamenteninduzierter Lupus |
| Sm | 5 | hoch | Nephritis, ZNS-Beteiligung |
| U1-RNP | 30 | niedrig | RAYNAUD-Phänomen, Myositis |
| SS-A (Ro) | 30 | niedrig | SJÖGREN-Syndrom, neonataler Lupus, kongenitaler Herzblock, subakuter kutaner Lupus, Photosensitivität, Lymphopenie, Pneumonitis |
| SS-B (La) | 15 | niedrig | SJÖGREN-Syndrom, Hypergammaglobulinämie, Rheumafaktor, seltene Nephritis |
| Rheumafaktor | 30 | niedrig | sekundäres SJÖGREN-Syndrom |
| Cardiolipin | 24 | niedrig | Thrombosen, cerebrovaskulärer Insult, Anfallsleiden, katastrophales Antiphospholipid-Syndrom |
| PCNA (Cyclin) | 1 | hoch | proliferative Nephritis |
| Ku | 19 | niedrig | keine Angaben |
| ribosomale Proteine | 11 - 38 | hoch | Psychosen |
| Zellmembran - Erythrozyten - Lymphozyten - Thrombozyten | 65 47 häufig | niedrig niedrig niedrig | Coombs-positive hämolytische Anämie Lymphozytopenie Thrombozytopenie |
Antikörper gegen cytoplasmatische Antigene neutrophiler Granulozyten (ANCA)
Die Diagnostik systemischer Vaskulitiden stützt sich auf das klinische Bild, auf Ergebnisse bildgebender Verfahren, auf Laborbefunde sowie die histologische Untersuchung von Gefäßbiopsien. Bei vielen Patienten mit Immunvaskulitiden klein- und mittelkalibriger Gefässe lassen sich Antikörper gegen cytoplasmatische Antigene neutrophiler Granulozyten nachweisen. Im indirekten Immunfluoreszenztest treten diese als "ANCA" („Anti Neutrophil Cytoplasmic Antibodies“) bezeichneten Autoantikörper in zwei charakteristischen Fluoreszenzmustern auf:
- Das sogennante c-ANCA-Muster ("c" für cytoplasmatisch) tritt vor allem bei Patienten mit Morbus Wegener (bis zu 95 % der Patienten mit aktiver fortgeschrittener Erkrankung), seltener bei anderen Erkrankungen (mikroskopische Polyangiitis, CHURG-STRAUSS-Syndrom, pauciimmune Glomerulonephritis, 35 - 40 %) auf.
- Die p-ANCA-Fluoreszenz ("p" für perinukleär) kommt vor allem bei mikroskopischer Polyangiitis und bei nekrotisierender rapid progressiver Glomerulonephritis vor (jeweils 50 - 60 % der Fälle).
Zielantigene der ANCA sind unterschiedliche Bestandteile der azurophilen alpha-Granula der Granulozyten stellen. Diagnostisch relevant sind hierbei vor allem Proteinase 3 (PR3/Myeloblastin, PR3-ANCA, vor allem bei Morbus WEGENER) und Myeloperoxidase (MPO, MPO-ANCA, übrige o. g. Erkrankungen). Frühere Empfehlungen verwiesen auf den ANCA-IFT als Screeningtest, positive Ergebnisse sollten grundsätzlich durch spezifische Methoden (Nachweis von PR3- und MPO-Ak) ergänzt werden. Nach aktuellen Empfehlungen sollten heute bei V. a. ANCA-assoziierte Immunvaskulitis bereits zu Beginn die spezifischen Tests auf PR3-ANCA und MPO-ANCA zum Einsatz kommen. Die Konzentrationen von ANCA korrelieren häufig mit der klinischen Aktivität der zugrundeliegenden Erkrankung bzw. mit immunsuppressiven Massnahmen. Dies gilt für die meisten c-/PR3-ANCA sowie für 50 - 60 % der p-/MPO-ANCA-positiven Patienten. Für die Beurteilung sind vor allem die individuellen Titerverläufe bedeutsam, da ANCA gelegentlich auch bei Patienten in klinischer Remission nachweisbar bleiben können.
Nicht alle ANCA werden durch Antikörper gegen PR3 oder MPO verursacht. Häufig kommen im IFT atypische ANCA mit unbekannter Spezifität vor, die vorübergehend auch als x-ANCA bezeichnet wurden (Bezeichnung obsolet). Sie sind vor allem bei Colitis ulcerosa und primär sklerosierender Cholangitis (PSC), gelegentlich bei chronischer autoimmuner Hepatitis oder rheumatoider Arthritis nachweisbar. Andere Antikörper z. B. gegen Kathepsin G, Lactoferrin, Lysozym, Elastase, BPI (bactericidal permeability increasing protein), Azurozidin oder alpha-Enolase sind sehr selten Ursache eines positiven ANCA-Screeningtests (meist p-ANCA). Diagnostisch sind ANCA un-klarer oder seltener Spezifität von geringer Bedeutung.
Tabelle 8: Häufigkeit von c- und p-ANCA [18]
| Erkrankungen | PR3-/c-ANCA [%] | MPO-/p-ANCA [%] | Spezifität [%] | Zielantigene |
|---|---|---|---|---|
| WEGENER-Granulomatose - Initialphase - Generalisation | 50 90 | < 5 < 5 | ca. 95 ca. 95 | PR3 PR3 |
| CHURG-STRAUSS-Syndrom | 10 - 40 | 0 - 30 | PR3 | |
| Mikroskopische Polyangitis | 15 | 75 | MPO | |
| Pauci-immune RPGN | 60 - 90 | MPO | ||
| Purpura SCHÖNLEIN-HENOCH | < 5 | < 5 | ||
| Panarteriitis nodosa | 10 | < 5 | ||
| Riesenzellarteriitis | 5 |
| Kollagenosen und andere Erkrankungen | c-ANCA [%] | p-ANCA [%] | Spezifität [%] | Zielantigene |
|---|---|---|---|---|
| Systemischer Lupus erythematodes | bis 25* | MPO, LF, HLE, LZ | ||
| SJÖGREN-Syndrom | bis 25* | LF, HLE; CG, LZ | ||
| Polymyositis | < 10* | LF, HLE; CG, LZ | ||
| Rheumotoide Arthritis | bis 20* | LF, HLE; CG, LZ | ||
| Rheumatoide Vaskulitis | bis 50* | LF, HLE; CG, LZ | ||
| FELTY-Syndrom | bis 50* | LF, HLE; CG, LZ | ||
| Spondarthritiden | < 10* | LF, HLE; CG, LZ | ||
| Primär Sklerosierende Chlangitis | bis 45* | BPI | ||
| Colitis ulcerosa | ca. 30* | CG, BPI | ||
| Hepatitis C | ca. 30* | |||
| Cystische Fibrose | BPI |
Da sich PR3-ANCA in der Frühphase des M. WEGENER nur in ca. 40 – 55 %, (bei fortgeschrittener Erkrankung ca. 90 %), und MPO-ANCA bei mikroskopischer Polyangiitis (mPAN) in maximal 75 % der Fälle nachweisen lassen, kommt diesen Parametern wegen der geringen Prävalenz solcher Erkrankung nur ein niedriger negativer prädiktiver Wert sowie auch ein vergleichsweise geringer positiver prädiktiver Wert zu. Ihre Bestimmung ist daher zu Screeningzwecken nur mit Einschränkungen geeignet und sollte stets nur bei begründetem klinischem Verdacht veranlasst werden. Da die meisten positiven Ergebnisse im (p-)ANCA-IFT nicht von Patienten mit Immunvaskulitiden, sondern von Patienten mit anderen, z. B. rheumatischen, intestinalen oder Leber-Erkrankungen stammen, ist der ANCA-IFT als Screening-Test für idiopathische systemische Immunvaskulitis heute obsolet.